Descrição das Famílias da Tabela Periódica (V)
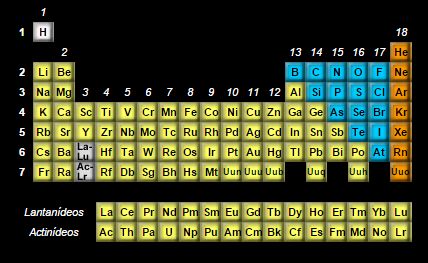
Grupo 3 a 12 – Metais de Transição (Famílias B)
Os elementos pertencentes aos grupos 3 ao 12 são também chamados de metais de transição. Os elementos de transição são considerados os possuidores dos orbitais de valência 3d, 4d e 5d, além dos lantanídeos e os actinídeos, que possuem orbitais de valência 4f e 5f. Os lantanídeos e os actinídeos são denominados elementos de transição interna.Os elementos de transição receberam esta denominação de Mendeleev, que verificou que as propriedades destes elementos eram intermediárias às dos elementos, que hoje são classificados como, bloco s e bloco p. Os elementos de transição possuem características que os diferenciam de qualquer outro conjunto de grupos de elementos da Tabela Periódica. Todos os elementos de transição são metais e possuem alta condutividade térmica e elétrica. Em adição em ligas metálicas, aumenta a temperatura de fusão e ebulição, além de aumentar a resistência mecânica da liga. Muitos elementos de transição possuem vários estados de oxidação, geralmente, mais de dois. Alguns destes elementos, como o ferro e o cobre são conhecidos e utilizados desde a antiguidade. O ferro meteórico era trabalhado à milhares de anos, antes mesmo da metalurgia surgir. Algumas civilizações acreditavam em um mito que o céu era constituído de ferro, e quando se quebrava, caía um pedaço na Terra, que na verdade era ferro meteórico, oriundo do espaço. O cobre é um outro elemento trabalhado desde a antiguidade, que era moldado a marteladas. Após o desenvolvimento da metalurgia, passou a ser possível derreter o cobre, surgindo então a Idade do Bronze, quando se construíam objetos a partir liga de cobre e estanho. Não somente o cobre e o ferro são conhecidos e utilizado a tanto tempo, há também o ouro e a prata, que desde o início de sua utilização são desejados e apresentam aplicações voltadas para a área financeira e de ornamentação (ver aplicações de ouro e prata).Alguns elementos de transição, como dito, são conhecidos e utilizados desde muito tempo, mas outros foram obtidos ou sintetizados há poucos séculos, ou décadas.
| Referência bibliográfica: 1. Medeiros, M. A.; Texto retirado na íntegra do software QuipTabela 4.01; 2004. |
Aplicações para estes elementos são encontradas nas mais diversas áreas da indústria e da pesquisa. Algumas aplicações comuns para muitos destes elementos são na constituição de ligas metálicas para os mais diversos fins e corantes, entre tantas outras importantes aplicações destes elementos (ver aplicações dos elementos de transição).
Série dos Lantanídeos
Os elementos da série dos lantanídeos são também conhecidos como lantanóides ou terras-raras. O termo terra-rara foi usado, inicialmente, para descrever qualquer óxido de ocorrência pouco conhecida e até, aproximadamente, 1920, ThO2 e ZrO2 eram incluídos como terras-raras. Depois de algum tempo, a denominação terras-raras passou a ser empregada para os elementos e não mais para os seus óxidos. Esta classificação passou a ser mais restrita, sendo dada para elementos que dificilmente se separam. Os metais terras-raras, geralmente, ocorrem na natureza juntos, no mineral monazita e gadolinita. Estes elementos são: lantânio, cério, praseodímio, neodímio, promécio, samário, európio, gadolínio, térbio, disprósio, hólmio, érbio, túlio, itérbio, lutécio e algumas vezes: ítrio e escândio.
Os elementos terras-raras foram isolados a partir do século XIX, principalmente a partir de 1839, quando C. G. Mosander isolou o cério e o lantânio, que também isolou, em 1843, o ítrio, o térbio e o érbio. Outros 11 elementos foram isolados até o início do século XX, mas só em 1945, que o promécio foi observado e isolado a partir de produtos de fissão do urânio-235, por cientistas americanos ( ver histórico do elemento).
Os lantanídeos apresentam propriedades químicas semelhantes, no entanto, elas não variam de maneira periódica. Esse foi um problema para a colocação deles na Tabela Periódica.
| Referência bibliográfica: 1. Medeiros, M. A.; Texto retirado na íntegra do software QuipTabela 4.01; 2004. |
Entretanto, estudos sobre estruturas eletrônicas e números atômicos possibilitaram a verificação que os elétrons mais externos destes elementos ocupavam o nível n = 4, e o orbital 4f era preenchido por elétrons. Isso colocou os elementos dispostos em uma série isolada do bloco principal da tabela. Essa série foi colocada na horizontal, pois a homogeneidade dos elementos aparece com o aumento do número atômico.
Série dos Actinídeos
Os elementos da série dos actinídeos também são chamados de actinóides. Eles formam um grupo de 14 elementos, excluído o actínio.
O nome actinídeo é uma referência ao actínio, o protótipo da série.
Em 1945, Glenn T. Seaborg publica uma tabela periódica, na qual há pela primeira vez uma nova série de elementos, que tinha o tório como inicial. Essa série de elementos era os actinídeos.
Essa nova série de elementos possuía apenas o tório, o protactínio e o urânio como elementos naturais. No entanto, a partir de meados da década de 1940, estudos sobre síntese de átomos pesados se concretizaram e foram produzidos os elementos: netúnio, plutônio, amerício, cúrio, berquélio, califórnio, einstéinio, férmio, mendelévio, nobélio e laurêncio. Esses eram os elementos da série dos actinídeos, que possuíam elétrons preenchendo o orbital 5f, o que lhes conferiam um diferencial, assim como os lantanídeos.
A descoberta de pelo menos a metade dos elementos dessa série se deve aos estudos e trabalhos desenvolvidos com o auxílio de Seaborg, que também propôs a série.
A maioria dos elementos desta série é artificial e todos são radioativos, entretanto, isso não impede que eles sejam utilizados pelo homem. Atualmente, diversas aplicações existem para estes elementos, mas a maioria voltada para suas propriedades radioativas, como produção de energia.
| Referência bibliográfica: 1. Medeiros, M. A.; Texto retirado na íntegra do software QuipTabela 4.01; 2004. |
Os estudos do desenvolvimento destes elementos possibilitaram a síntese de outros elementos de transição, os chamados transactinídeos, que se iniciam a partir do número atômico 104.
Para ver mais sobre Família IA e IIA, clique aqui.
Para ver mais sobre Família IIIA e IVA, clique aqui.


 Quando se ouve falar de fósforo, o que a maioria das pessoas pensam inicialmente?
Quando se ouve falar de fósforo, o que a maioria das pessoas pensam inicialmente?




 Alguns exemplos de silicatos, presentes na crosta terrestre, são: talco – Mg3(Si4O10)(OH)2, topázio – Al2SiO4(F,OH)2, turmalina schorlita – NaFe3Al6(BO3)3Si6O18(OH)4, zircão – ZrSiO4, entre outros.
Alguns exemplos de silicatos, presentes na crosta terrestre, são: talco – Mg3(Si4O10)(OH)2, topázio – Al2SiO4(F,OH)2, turmalina schorlita – NaFe3Al6(BO3)3Si6O18(OH)4, zircão – ZrSiO4, entre outros.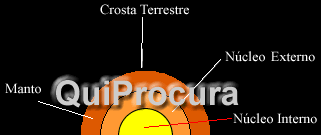
 Os compostos de silício possuem diversas aplicações, das quais se destacam: fabricação de cimentos, cimentos amianto, vidros, semicondutores e silicones (espécie de polímero que pode ser obtido na forma de resina, emulsão ou na forma fluida ou emborrachada). Alguns compostos são, ainda, utilizados como pedras ornamentais (topázio, ametista, etc). Além disso, o silício é empregado na produção de chips e placas de circuitos integrados de aparelhos eletro-eletrônicos como rádios, telefones celulares e computadores. Na produção destas placas, em uma das etapas, há a deposição de uma camada de SiO2 sobre uma pastilha de silício.
Os compostos de silício possuem diversas aplicações, das quais se destacam: fabricação de cimentos, cimentos amianto, vidros, semicondutores e silicones (espécie de polímero que pode ser obtido na forma de resina, emulsão ou na forma fluida ou emborrachada). Alguns compostos são, ainda, utilizados como pedras ornamentais (topázio, ametista, etc). Além disso, o silício é empregado na produção de chips e placas de circuitos integrados de aparelhos eletro-eletrônicos como rádios, telefones celulares e computadores. Na produção destas placas, em uma das etapas, há a deposição de uma camada de SiO2 sobre uma pastilha de silício.
