Silício – aplicações
O silício é, atualmente, um elemento químico de grande importância para a humanidade. Mas, não é só nos dias de hoje que compostos de silício são valorizados e utilizados.
Há aproximadamente 500 mil anos atrás, na Era paleolítica (também denominada Idade da Pedra), compostos de silício eram utilizados para produção de objetos e ferramentas.
Muitos anos depois que o primeiro objeto com silício em sua estrutura foi utilizado, um cientista, J. J. Berzelius, em 1823, isolou o elemento a partir da redução de K2SiF6 com potássio fundido.
O silício é um elemento representativo e ametal, número atômico 14 e massa molar 28,09 g/mol, ele se encontra no 14º grupo da tabela periódica, o grupo do carbono. O seu símbolo químico é “Si” e seu nome deriva do latim sílex, quartzo.
Do grão de areia …
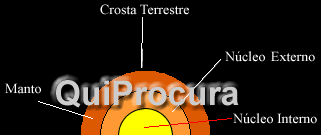
O silício, segundo elemento mais abundante da crosta terrestre, representando 27% de sua possível massa, pode se apresentar, na natureza, de diversas formas, mas nunca como silício puro.
A maneira mais comum de se encontrar silício é na forma de silicatos (a mais importante classe de minerais). Estima-se que 40% dos minerais conhecidos sejam da classe dos silicatos.
|
Silicato é uma classe de minerais que possuem o silício em sua composição básica. A maioria dos silicatos possui o grupo SiO4, com pequenas exceções. Mas todos possuem o silício agrupado ao oxigênio.
|
 Alguns exemplos de silicatos, presentes na crosta terrestre, são: talco – Mg3(Si4O10)(OH)2, topázio – Al2SiO4(F,OH)2, turmalina schorlita – NaFe3Al6(BO3)3Si6O18(OH)4, zircão – ZrSiO4, entre outros.
Alguns exemplos de silicatos, presentes na crosta terrestre, são: talco – Mg3(Si4O10)(OH)2, topázio – Al2SiO4(F,OH)2, turmalina schorlita – NaFe3Al6(BO3)3Si6O18(OH)4, zircão – ZrSiO4, entre outros.
O SiO2 é um caso interessante, ele (SiO2) é fórmula para sílica (constituinte principal da areia) e também para o quartzo, mas qual é a diferença entre eles?
A diferença entre a sílica e o quartzo é a forma de agrupamento. Enquanto na sílica o SiO2 se cristaliza em cristais pequenos, no quartzo o SiO2 cristaliza e arranja-se em um agrupamento maior, podendo ou não ter impurezas, o que caracterizará outras variedades de quartzo. Exemplos: ametista (impureza de Mn3+) e citrino (impureza de Fe2+).
Saindo da crosta terrestre e descendo em direção ao centro da Terra, encontraremos o manto terrestre que corresponde, provavelmente, a 68% da massa da Terra. E estima-se, que ele seja constituído, basicamente, por óxidos de ferros e silicatos, como a olivina (Mg, Fe)2SiO4.
… ao circuito de computador
 Os compostos de silício possuem diversas aplicações, das quais se destacam: fabricação de cimentos, cimentos amianto, vidros, semicondutores e silicones (espécie de polímero que pode ser obtido na forma de resina, emulsão ou na forma fluida ou emborrachada). Alguns compostos são, ainda, utilizados como pedras ornamentais (topázio, ametista, etc). Além disso, o silício é empregado na produção de chips e placas de circuitos integrados de aparelhos eletro-eletrônicos como rádios, telefones celulares e computadores. Na produção destas placas, em uma das etapas, há a deposição de uma camada de SiO2 sobre uma pastilha de silício.
Os compostos de silício possuem diversas aplicações, das quais se destacam: fabricação de cimentos, cimentos amianto, vidros, semicondutores e silicones (espécie de polímero que pode ser obtido na forma de resina, emulsão ou na forma fluida ou emborrachada). Alguns compostos são, ainda, utilizados como pedras ornamentais (topázio, ametista, etc). Além disso, o silício é empregado na produção de chips e placas de circuitos integrados de aparelhos eletro-eletrônicos como rádios, telefones celulares e computadores. Na produção destas placas, em uma das etapas, há a deposição de uma camada de SiO2 sobre uma pastilha de silício.
*O texto e as figuras desta página foram produzidos por Miguel A. Medeiros. A reprodução destes, merece autorização ou referência ao autor. Além do endereço desta página.



 Quando se ouve falar de fósforo, o que a maioria das pessoas pensam inicialmente?
Quando se ouve falar de fósforo, o que a maioria das pessoas pensam inicialmente?




 Alguns exemplos de silicatos, presentes na crosta terrestre, são: talco – Mg3(Si4O10)(OH)2, topázio – Al2SiO4(F,OH)2, turmalina schorlita – NaFe3Al6(BO3)3Si6O18(OH)4, zircão – ZrSiO4, entre outros.
Alguns exemplos de silicatos, presentes na crosta terrestre, são: talco – Mg3(Si4O10)(OH)2, topázio – Al2SiO4(F,OH)2, turmalina schorlita – NaFe3Al6(BO3)3Si6O18(OH)4, zircão – ZrSiO4, entre outros.
 Os compostos de silício possuem diversas aplicações, das quais se destacam: fabricação de cimentos, cimentos amianto, vidros, semicondutores e silicones (espécie de polímero que pode ser obtido na forma de resina, emulsão ou na forma fluida ou emborrachada). Alguns compostos são, ainda, utilizados como pedras ornamentais (topázio, ametista, etc). Além disso, o silício é empregado na produção de chips e placas de circuitos integrados de aparelhos eletro-eletrônicos como rádios, telefones celulares e computadores. Na produção destas placas, em uma das etapas, há a deposição de uma camada de SiO2 sobre uma pastilha de silício.
Os compostos de silício possuem diversas aplicações, das quais se destacam: fabricação de cimentos, cimentos amianto, vidros, semicondutores e silicones (espécie de polímero que pode ser obtido na forma de resina, emulsão ou na forma fluida ou emborrachada). Alguns compostos são, ainda, utilizados como pedras ornamentais (topázio, ametista, etc). Além disso, o silício é empregado na produção de chips e placas de circuitos integrados de aparelhos eletro-eletrônicos como rádios, telefones celulares e computadores. Na produção destas placas, em uma das etapas, há a deposição de uma camada de SiO2 sobre uma pastilha de silício.




