QuiProcura Química

Ligação covalente Polar e Apolar
Ligação Covalente
A ligação covalente ocorre entre átomos com eletronegatividades semelhantes. Em uma ligação covalente, os elétrons de um átomo são compartilhados com o outro átomo envolvido na ligação. Nessa ligação, nenhum elétron da ligação é removido (como ocorre na ligação iônica).
Quando átomos se unem, se ligam apenas por ligações covalentes, forma-se uma molécula.
| Eletronegatividade – É a capacidade de um átomo, participante de uma ligação, em atrair elétrons para sua proximidade.
Os elementos considerados mais eletronegativos são: F (flúor), O (oxigênio), N (nitrogênio), Cl (cloro), Br (bromo), I (iodo), S (enxofre), C (carbono), P (fósforo), H (hidrogênio). |
Ligação Covalente Polar
A ligação covalente polar ocorre quando dois átomos com eletronegatividades diferentes formam uma ligação covalente. Neste tipo de ligação, os elétrons NÃO são igualmente compartilhados. Normalmente, o átomo com maior eletronegatividade atrai os elétrons da ligação para próximo dele, formando assim um polo negativo em suas proximidades e um polo positivo na região próxima do átomo menos eletronegativo.
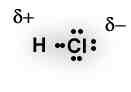
Na molécula de H-Cl, ácido clorídrico, o átomo de cloro é o mais eletronegativo, atraindo para sua proximidade os elétrons da ligação com o átomo de hidrogênio, que é menos eletronegativo, ou também classificado como mais eletropositivo.
O entendimento de ligações covalentes polares é de fundamental importância para compreender geometria molecular.
Ligação Covalente Apolar
A ligação covalente apolar ocorre quando dois átomos com eletronegatividades iguais formam uma ligação covalente. Neste tipo de ligação, os elétrons são igualmente compartilhados pelos átomos da ligação. Normalmente, a ligação covalente apolar ocorre entre átomos iguais, não havendo a formação de polos positivos ou negativos.
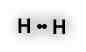
Na molécula de H – H, gás hidrogênio, os átomos de hidrogênio compartilham igualmente os elétrons da ligação. É dito que os elétrons de uma ligação covalente apolar estão equidistantes dos átomos.
Escrito por: Miguel A. Medeiros
Publicado em: 23 de novembro de 2015



Trackbacks & Pingbacks
[…] Ligação Covalente Polar e Apolar […]
Os comentários estão fechados.