Escrito por: Miguel Araujo Medeiros
Publicado em: 15 de novembro de 2002
Revisado em: 27 de junho de 2015
Os compostos químicos de uma forma em geral, absorvem radiação nas regiões do ultra-violeta, do visível e também na região do Infravermelho do espectro eletromagnético .
A radiação infravermelha provoca vibração de átomos ou grupos de átomos em um composto, estas vibrações podem ter amplitudes e velocidades diferentes. Estas vibrações ocorrem em torno das ligações covalentes que une os átomos, ou grupos de átomos.
O Infravermelho não só pode ser usado para compostos orgânicos, como também para compostos inorgânicos, tais como complexos de coordenação.
A energia das vibrações são quantizadas, ou seja, existem determinadas quantidades de energia que fazem os grupos vibrarem.
As fontes de radiação devem apresentar comportamento próximo ao do corpo negro. Comumente utiliza-se filamento de tungstênio, carbeto de silício, liga de níquel-cromo, lâmpadas de mercúrio e, lasers. Algumas dessas fontes operam mais eficientemente em determinadas faixas do espectro infravermelho.
Como funcionam os Espectrômetros de Infravermelho
Geralmente é necessário preparar a amostra a ser analisada, de forma a colocá-la no interior do espectrômetro, na forma de uma pastilha homogênea. (Pode-se utilizar também, amostras líquidas ou gasosas.)
Os raios Infravermelhos incidirão na amostra e os raios serão comparados com outros (de referência), isso é feito à medida que a frequência da radiação incidente é alterada. A partir disso, o espectrômetro plotará um gráfico com os resultados, ou seja, ele mostrará a absorção em função da frequência.
 |
 |
.gif) |
Modos de Vibração das Moléculas. Neste exemplo é
verificado a molécula de água.
Geralmente, encontram-se tabelas com valores de absorção para compostos orgânicos, ou seja, átomos e grupos de átomos ligados à carbono, no entanto, na química de complexos de coordenação, as vibrações observadas são entre íons metálicos e grupos ou átomos. Em uma situação assim, pode-se utilizar estas tabelas, fazendo uma aproximação dos valores das vibrações. No entanto, existem também, tabelas com dados para alguns íons metálicos, mas estas são de maior dificuldade para se encontrar.
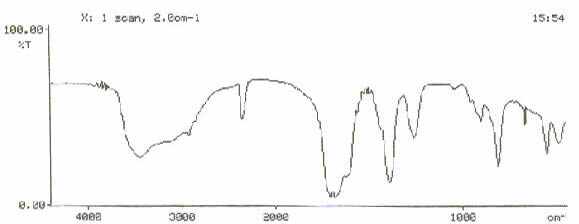
Espectro de Infravermelho do complexo trans-dioxalato-diaquacromato(III) de potássio
Um maneira para se obter informações sobre a geometria de uma molécula, consiste em imaginar todos os arranjos possíveis dos átomos na molécula. Classificar cada uma das possíveis estruturas segundo seu grupo pontual derivado pela teoria de grupo. Através desta caracterização podemos identificar quantos e de que tipo são os graus de liberdade e quantas bandas no infravermelho terão possibilidade de serem observadas. Obtém-se experimentalmente o espectro vibracional da molécula e procura-se identificar as bandas fundamentais, dos sobretons, das bandas de combinação e conta-se quantas são as fundamentais. Comparando-se com aquelas previstas pela teoria de grupo, teremos informações de como deve ser a distribuição dos átomos na molécula.
O grande problema experimental seria a metodologia para fazer-se a atribuição das bandas. Não existe nenhum critério rigoroso para se efetuar tal medida. Esta etapa é realizada através de comparações entre espectros de várias moléculas ou ainda efetuando comparações com moléculas isotopicamente substituídas ou comparando-se com espectros obtidos através do método Raman. Podemos ainda criar um campo de força e tentar reproduzir as frequências vibracionais através de métodos matemáticos. Dentre estes métodos é possível ajustar-se constantes de força para diferentes tipos de ligação química e, com estas constantes, calcular-se os parâmetros geométricos, como ocorre nos métodos conhecidos como mecânica molecular.
*O texto e as figuras desta página foram produzidos por Miguel A. Medeiros. A reprodução destes, merece autorização ou referência ao autor. Além do endereço desta página.