QuiProcura Química
Interações Intermoleculares
No estado gasoso as moléculas se encontram bem afastadas, com grande grau de desordem.
No estado líquido as moléculas se encontram um pouco mais organizadas, com um grau de liberdade de movimentação um pouco menor. Já no estado sólido as moléculas se encontram bem mais organizadas, com grau de movimentação ainda mais reduzido.

O que faz as moléculas ficarem mais unidas no estado sólido do que no estado líquido ou gasoso?
Isso é responsabilidade das forças intermoleculares (ou interações intermoleculares ou ligações intermoleculares). E elas são de 3 tipos: interação de Van der Waals ou de London, ou ainda interação dipolo induzido; interação diplo-dipolo e ligação de hidrogênio.
Interação dipolo-dipolo
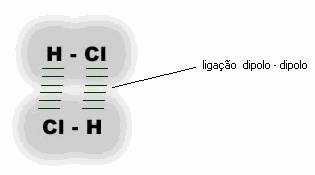
Considerando uma molécula de de H-Cl, temos que ocorre formação de pólos em sua estrutura, ou seja, o cloro atrairá mais o e– do que o hidrogênio, devido à sua maior eletronegatividade, sendo assim a parte do Cl ficará negativa e a parte do H ficará positiva e essa polarização será permanente. Sendo assim, considere agora várias moléculas de H – Cl. Uma molécula atrairá a outra. A parte parcialmente negativa de uma molécula atrai a parte parcialmente positiva da outra molécula e assim se dá entre todas as moléculas do líquido ou sólido formado por HCl.
Esse tipo de interação entre as moléculas é característico de todas moléculas polares.
Interação de Hidrogênio:
Quando uma molécula tiver um H ligado a um elemento eletronegativo (F,O,N) haverá uma grande polarização da molécula, sendo assim, se esta molécula aproximar de uma outra molécula que possuir F,O,N ocorrerá a formação da Ligação de Hidrogênio que é uma força bastante intensa em relação às outras forças intermoleculares.
Este tipo de ligação (interação) é um caso especial de interação dipolo-dipolo, só ocorrendo então entre moléculas polares.
Exemplo: moléculas de água , de NH3 ,de H-F em H2O, ou NH3 formam ligação de hidrogênio entre si.

Interação de Van der Waals
Ligação que ocorre entre todas as moléculas até entre as apolares, sendo o único tipo de interação entre moléculas apolares.
Em uma molécula apolar a ligação existente é entre elementos com eletronegatividades semelhantes, ou igual, ficando os elétrons da ligação “indecisos” em relação à sua posição, ou seja, ele não sabe para qual átomo ele se aproxima mais. Ora ele está em um elemento, ora em outro, fazendo a molécula, ora possuir um polo positivo de um lado, ora do outro lado.
Sendo isso que gera a ligação dipolo induzido, ou ligação de Van der Waals, o dipolo momentâneo na molécula.
Força relativa das interações intermoleculares
Van der Waals < dipolo-dipolo < ligação de Hidrogênio.
Temperatura de ebulição:
Existe uma relação importante entre interações intermoleculares e temperatura de ebulição, pois quanto mais forte for a interação que as moléculas de um determinado líquido fizer, maior será sua temperatura de ebulição.
Para compara temperatura de ebulição, também deve-se considerar o peso da molécula, mas não dá para analisar a molécula pelas duas regras de uma só vez, deve se manter uma delas constante e olhar a outra.
Exemplo:
Substâncias com massa molecular próximas: a substância que fizer interação mais intensa é a que tem temperatura de ebulição maior, mas se as duas fizerem a mesma interação e tiverem massas diferentes a de maior massa terá a maior temperatura de ebulição.
Isso é muito importante saber, pois a partir dessa relação entre interação intermolecular e massa molar se pode ter uma ideia do estado físico da substância à uma determinada temperatura.

