Ligações Químicas
Escrito por: Miguel A. Medeiros
Revisado em: 28 de junho de 2015
As ligações químicas podem ser covalente e iônica. São através dessas ligações que os átomos se unem e formam todos os compostos presentes no universo, seja um sal como o NaCl, um carboidrato ou até mesmo uma proteína.
Se colocarmos um pouco de água do mar em um recipiente e aquecê-la, notaremos que a água evaporará, restando no recipiente um depósito, um precipitado. Você é capaz de dizer pelo menos um composto presente neste depósito?
Nele se encontra NaCl, MgCl2, CaCO3, CaSO4, KBr, MgSO4 e KCl.
O composto em maior proporção é o NaCl, o principal composto do sal de cozinha.
O ar atmosférico é rico em diversos compostos, uma análise química detecta a presença de diversos compostos moleculares e atômicos. O2,N2,CO2,H2O,CO,SO2,NO2 são exemplos de compostos encontrados no ar, além do He, Ne, Ar, que são gases nobres.
Com isso é possível notar que tanto na água do mar, quanto no ar existe uma diversividade grande de compostos, sendo possível agrupá-los segundo algumas regras particulares, ou seja, a partir das ligações formadoras destes compostos.
Gases nobres:
São elementos considerados inertes, pois eles são estáveis e não têm tendencia de reagir quimicamente, ou seja, eles não se encontram em compostos naturais. (No entanto, há produtos sintetizados que possuem gases nobres, tais como xenônio).
Os gases nobres possuem 8 elétrons na camada de valência, exceto o He com 2 elétrons, sendo assim todos os outros elementos tendem a buscar essa estabilidade, alguns perdendo e outros ganhando elétrons.
Informações mais detalhadas sobre os gases nobres podem ser encontradas em http://quiprocura.net/w/portfolio-item/descricao-das-familias-da-tabela-periodica/#tab-id-9
Regra do octeto:
Um átomo estará estável quando sua última camada possuir 8 e– (no caso de átomos como o H e He a camada possui 2 e– ). Os átomos não estáveis se unem uns aos outros a fim de adquirir essa configuração de estabilidade.
A união entre átomos é chamada ligação química. Sendo a ligação química que irá estabilizar os átomos, estas ligações podem ser iônicas, covalentes ou metálicas.
Ligações Covalentes Polares e Apolares
Ligação iônica:
Assim como os metais, o cloreto de sódio líquido (acima de 800°C), ou em solução, conduz corrente elétrica. No caso do cloreto de sódio, a condução de corrente elétrica se dá pelo movimento dos íons.
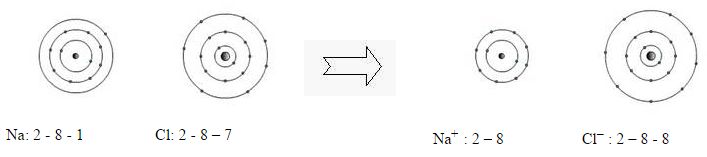
Cloreto de Sódio
Sejam as configurações eletrônicas do 11Na e 17Cl
| Na – 2 – 8 – 1 | Cl- 2 – 8 – 7 |
Para estabilizar o Na é melhor ganhar 7 e– ou perder 1 e– ? Será mais conveniente perder 1e– .
Para o Cl será melhor ganhar 1 e– .
Sendo assim o sódio ficará com a configuração do 10Ne e o Cl com a do 18Ar .
Quando o nº de e– é menor que o de prótons o composto é um cátion, mas quando o nº dee– é maior do que o de próton o composto é um ânion.
O que o Na+ é então?
E o Cl– ?
Na ligação iônica, teremos sempre transferência de elétrons.
Utilizando o método de Lewis, no qual é representado o último nível eletrônico do átomo ou camada de valência por pontos.
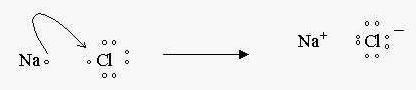
Atenção:
Após a ligação continuamos a ter os mesmos núcleos, porém agora em um mesmo composto, que só sofreu alteração entre os elétrons.
Outro composto iônico
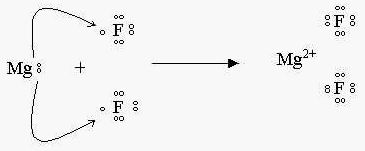
A proporção de ligantes irá depender do metal, ou seja, da valência que o metal possui.
Generalizando os íons dos metais são possíveis quando um átomo perde 1,2 ou 3 elétrons para se transformar em íon de carga +1, +2 ou +3.
Íons dos não metais são formados geralmente por átomos do grupo 7A, 6A e 5A, eles tendem a receber 1, 2 ou 3 elétrons, adquirindo carga -1, -2, ou -3.
Caso em que o elemento pode perder ou ganhar elétrons é o dos elementos da família 4A, ou seja, os elementos podem perder 4 e–, ou ganhar 4 e– .
Compostos iônicos
 |
compostos da direita para esquerda: cloreto de sódio NaCl, sulfato de cobre CuSO4. Na fila de cima, da esquerda para direita: cloreto de níquel NiCl2, dicromato de Potássio K2Cr2O7, cloreto de cobalto CoCl2. |
Cristal Iônico:
Como o Na+ e o Cl– têm cargas opostas eles se atraem, então temos o seu cristal.
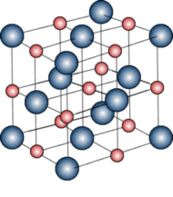 |
À esquerda, modelo do retículo NaCl, com os íons afastados da posição real, para que se possa “enxergar” melhor a disposição dos íons. | 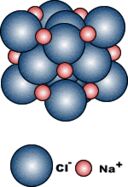 |
A
ligação iônica
, como o nome sugere, origina íons, isso graças a transferência de e– entre os átomos, geralmente os metais originam cátions e os não metais originam ânions.
Ligação Covalente
É o tipo de ligação que ocorre geralmente entre dois não metais, através do compartilhamento de elétrons, resultando em uma molécula (um agregado de átomos responsável pelas propriedades da substância). Sendo que todos os ligantes da molécula ficam com 8 elétrons cada.
Ligação covalente simples:
Ocorre entre dois átomos de um mesmo não metal.
Átomos de flúor (F2) , como a eletronegatividade dos átomos é igual, então não haverá um arranque de elétrons de um átomo para o outro e sim um empréstimo, ou compartilhamento dos elétrons da camada de valência.
____________
* a ligação covalente pode ocorre entre outros elementos, como metal e ametal, ou até mesmo entre metal e metal, pois lig. Covalente é compartilhamento de elétrons.
Representação da molécula pela fórmula de Lewis.
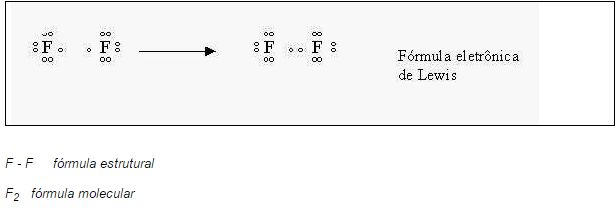
As ligações entre dois átomos de um mesmo elemento, formando uma molécula simples, se dá da mesma forma que no flúor.
Exemplos de outros tipos de ligação:
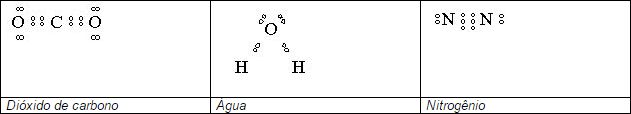
Os demais ametais formam ligações similares.
 |
Bromo e Iodo à esquerda e Nitrogênio líquido à direita. |  |
Ligações Covalentes Polares e Apolares
Ligações Químicas (Parte 2)
__________________________________