Isomeria Plana e Espacial
Isomeria é o fenômeno que possibilita a existência de dois ou mais compostos químicos com a mesma fórmula molecular, mas com fórmulas estruturais diferentes. O fenômeno da isomeria possibilita, que compostos com mesma fórmula molecular possua diferentes propriedades físicas e químicas, pois os átomos estão ligados de maneiras distintas (isomeria plana), ou simplesmente, disposto diferentemente no espaço (isomeria espacial).
A isomeria é um fenômeno bastante comum na química orgânica, podendo ser separada em isomeria plana e espacial.
Os compostos que sofrem isomeria são denominados de isômeros.
Na isomeria plana, os isômeros diferem um dos outros, apenas pela fórmula estrutural plana, sendo chamados de isômeros constitucionais.
Isomeria Plana (Isômeros Constitucionais)
Os isômeros constitucionais são compostos que diferem entre si por possuírem seus átomos ligados em ordens diferentes. Átomos ou grupos de átomos são ligados em posições diferentes. As conexões que os átomos fazem são diferentes, quando comparados 2 ou mais isômeros constitucionais. A isomeria plana pode ser dividida em 5 diferentes tipos:
Isomeria de posição
Os isômeros de posição pertencem a mesma função química (todos os isômeros são hidrocarbonetos, ou álcoois, ou ácidos carboxílicos, ou haletos de alquila, etc) e possuem a mesma cadeia carbônica, diferenciando apenas, pela posição de uma ramificação, ou de um grupo funcional, ou de uma insaturação (ligações duplas ou triplas).
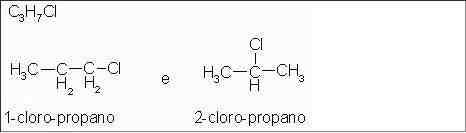
Haletos de alquila: 1-cloro-propano e 2-cloro-propano
Isômeros com diferentes posições do átomo de cloro na cadeira carbônica.
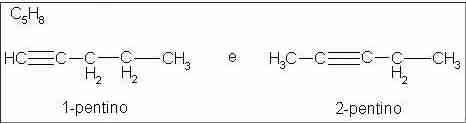
Alquinos: 1-pentino e 2-pentino
Isômeros com diferentes posições da ligação covalente tripla.
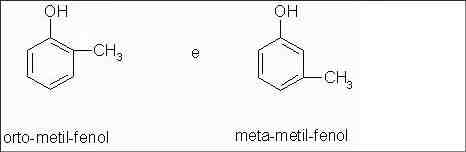
Fenóis: orto-metil-fenol e meta-metil-fenol
Isômeros com diferentes posições de radical metil.
Isomeria de cadeia ou núcleo
Os isômeros constitucionais classificados como isômeros de cadeia pertencem à mesma função química, mas possuem cadeias carbônicas diferentes. Os isômeros de cadeia podem, por exemplo, ser alcanos com cadeia linear e cadeia ramificada, ou alquenos com cadeia linear e alcano de cadeia cíclica.
Alcanos: butano e metil-propano
Isômeros com cadeias carbônicas diferentes, o primeiro é um alcano linear e o segundo é um alcano ramificado.
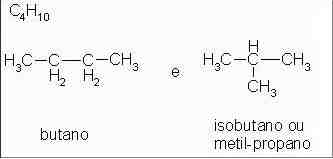
Alquenos e alcanos: penteno e ciclopentano
Isômeros que possuem cadeias carbônicas diferentes. Um dos isômeros é um alqueno de cadeia linear e o outro é um alcano cíclico, mas ambos com a mesma fórmula molecular.
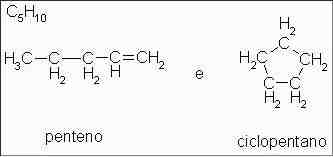
O 1-penteno e o ciclopentano são hidrocarbonetos, embora o penteno seja um exemplo de alqueno e o ciclopentano seja um exemplo de cicloalcano.
Isomeria de função
Os isômeros constitucionais classificados como isômeros de função apresentam funções químicas distintas.

Metameria ou isomeria de compensação
Os isômeros pertencem à mesma função e apresentam a mesma cadeia carbônica, mas apresentam diferença na posição do heteroátomo.
A metameria pode ser considerada um caso de isomeria de posição. (Heteroátomo – átomo dentro da cadeia carbônica diferente do carbono. São considerados heteroátomos: N, O, P, S).

Tautomeria
É um caso especial de isomeria de função.
A tautomeria acontece quando ocorre um rearranjo de átomos ou grupo de átomos em uma molécula. Os compostos que sofrem tautomeria estão em equilíbrio com sua forma isomérica, sendo que uma forma pode transformá-se em outra dependendo de variações de temperatura, pressão, ou outra variável do meio.

Estereoisomeria
Isomeria Espacial
Os isômeros espaciais possuem a mesma fórmula molecular e também a mesma fórmula estrutural plana, diferenciando apenas nas fórmulas estruturais espaciais.
Os isômeros espaciais podem ser divididos em geométricos e ópticos.
Isomeria geométrica (cis-trans ou Z-E)
Os isômeros são compostos que possuem a distribuição espacial diferentes. Este tipo de isomeria espacial, ocorre, caso existam ligações duplas ou cadeia fechada ou ainda, os ligantes estejam ligados à carbonos diferentes.
Os isômeros podem ser classificados como cis(Z) ou trans(E).
cis(Z) – do mesmo lado, juntos, no mesmo lado do plano de simetria.
trans(E) – em lados opostos do plano de simetria.

Os isômeros cis e trans possuem propriedades físicas diferentes, tais como, PF, PE e densidade.
.gif)
Isomeria óptica
Os isômeros ópticos são compostos que possuem os mesmos átomos constitutivos ligados exatamente na mesma sequência, ou seja, possuem as mesmas conexões. Os isômeros ópticos diferem entre si pela simples disposição dos átomos ou grupos de átomos no espaço.
Todos os isômeros possuem propriedades físicas diferentes, tais como temperatura de fusão, temperatura de ebulição e densidade, mas os isômeros ópticos não possuem diferenças em suas propriedades físicas, sendo as mesmas propriedades para um grupo de isômeros ópticos. Então o que faz eles serem diferentes?
É possível diferenciá-los?
Sim, é possível diferenciá-los, mas apenas quando eles estão frente à luz polarizada.
Luz polarizada – é um conjunto de ondas eletromagnéticas que se propagam em apenas uma direção.
Uma lâmpada comum é um exemplo de fonte de luz não polarizada, pois a luz é emitida em todas as direções. Por exemplo, uma lâmpada acessa no teto de um quarto ilumina toda a sua área, pois os raios de luz são direcionados para todas as direções, com ângulo de abertura próximo à 360°.
É possível polarizar luz não polarizada, bastando utilizar um polarizador, que terá a função de direcionar apenas uma direção da luz.

esta seta de duas pontas, ![]() , significa a propagação da onda eletromagnética (luz polarizada) vista de frente.
, significa a propagação da onda eletromagnética (luz polarizada) vista de frente.
Isômeros ópticos
Enantiômeros
Os isômeros ópticos são compostos capazes de desviar a luz polarizada. Caso o isômero óptico provoque o giro da luz polarizada para a direita, o enantiômero é denominado dextrogiro (D, +). Caso o enantiômero provoque o giro da luz polarizada para a esquerda, o composto é denominado levogiro (L, -).
É necessário atenção, pois os enantiômeros não são superponíveis, assim como o levogiro não se superpõe ao dextrogiro.
O fato de um composto provocar o “giro” da luz polarizada, faz com que ele possua atividade óptica.
Atividade óptica só é possível em moléculas assimétricas, ou seja, moléculas que possuem carbono quiral (ou estereocentro).

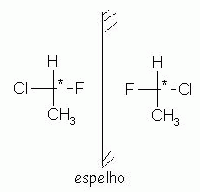
Compostos enantioméricos, um é a imagem especular do outro, ou seja, um é a imagem refletida do outro. No entanto, eles não são superponíveis. Um exemplo disso, são as mãos, direita e esquerda. Uma é a imagem da outra, mas não são superponíveis. Tente verificar este fato com suas mãos, coloque uma na frente da outra. (Uma será a imagem da outra).
Agora tente colocar uma sobre a outra. (As mãos não são superponíveis, ou seja, os dedos polegares não ficam um sobre o outro). Considere isso como um exemplo para entender o fato da assimetria molecular.
Mistura racêmica é uma mistura de isômeros ópticos, ou seja, é uma mistura de 50% de levogiro e 50% de dextrogiro.
A quantidade de isômeros opticamente ativos, pode ser dada a partir da quantidade de carbonos quirais em uma molécula.

IOA- isômero oticamente ativo
IOA = 2n , sendo n o número de estereocentros.
Para a molécula dada, temos:
IOA = 22 = 4 , 4 isômeros ópticos ativos.
Escrito por: Miguel A. Medeiros
Revisado em: 29 de junho de 2015




